GSH Cas: 70-18-8 98% Polvere cristallina bianca
| Numero di catalogo | XD90227 |
| nome del prodotto | GSH |
| CAS | 70-18-8 |
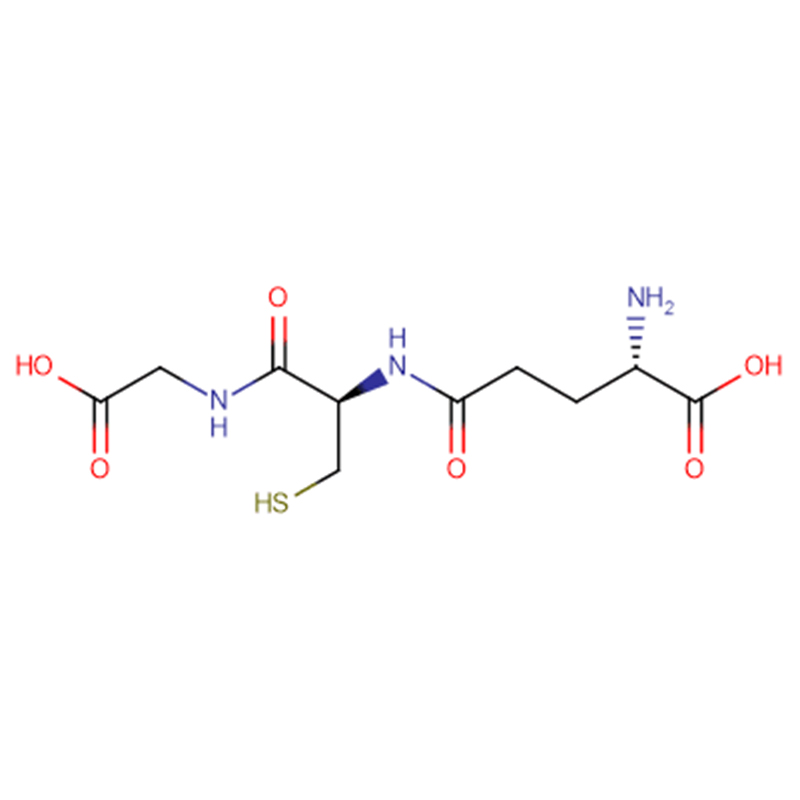
| Formula molecolare | C10H17N3O6S |
| Peso molecolare | 307.323 |
| Dettagli di archiviazione | da 2 a 8 °C |
| Codice tariffario armonizzato | 29309098 |
Specifiche di prodotto
| Specifiche di prodotto | |
| Punto di fusione | 185°C |
| Grado | Grado farmaceutico |
| Metalli pesanti | 10 ppm max |
| Arsenico | 2 ppm max |
| Identificazione | IR : Simile allo spettro di riferimento |
| Perdita all'essiccamento | 0,5% massimo |
| Temperatura di conservazione | +20°C |
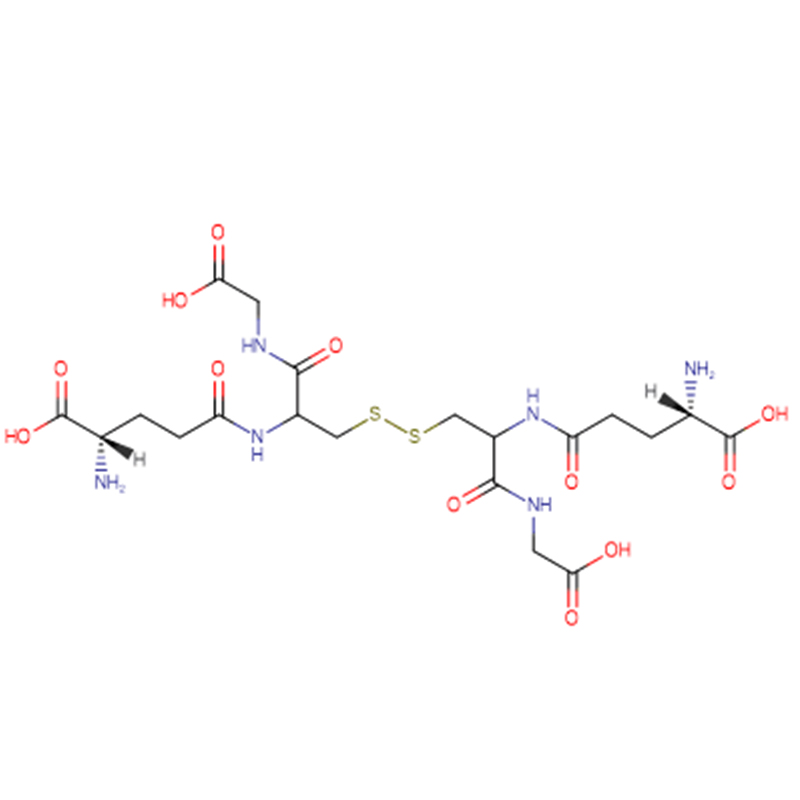
| Peso molecolare | 612.63 |
| Saggio | 98,0% min |
| Rotazione ottica | -15,5°- -17,5 gradi |
| Residuo all'accensione | 0,1% massimo |
| Chiarezza della soluzione | Chiaro e incolore |
| Aspetto | Polvere cristallina bianca |
| Sostanza correlata | Totale: 2,0% massimo, GSSG: 1,5% massimo |
La proteina ORF45 dell'herpesvirus associato al sarcoma di Kaposi (KSHV) è una proteina del tegumento immediato-precoce specifica per il gammaherpesvirus.I nostri studi precedenti hanno rivelato i suoi ruoli cruciali sia nelle fasi iniziali che in quelle tardive dell'infezione da KSHV.In questo studio, abbiamo esaminato l'interattoma di ORF45 utilizzando un pannello di anticorpi monoclonali.Oltre alle proteine chinasi regolate extracellulari (ERK) e p90 ribosomiale S6 chinasi (RSK) precedentemente identificate, abbiamo trovato molte altre proteine copurificate, comprese quelle prominenti di ~ 38 kDa e ~ 130 kDa.La spettrometria di massa ha rivelato che la proteina da 38 kDa è ORF33 virale e la proteina da 130 kDa è USP7 cellulare (proteasi 7 specifica dell'ubiquitina).Abbiamo mappato il dominio di legame ORF33 ai 19 aminoacidi carbossilici-terminali altamente conservati (aa) di ORF45 e il dominio di legame USP7 al motivo di consenso riportato nella regione centrale di ORF45.Usando la colorazione con immunofluorescenza, abbiamo osservato la colocalizzazione di ORF45 con ORF33 o USP7 sia in condizioni trasfettate che in cellule infette da KSHV.Inoltre, abbiamo notato la rilocalizzazione dipendente da ORF45 di una porzione di ORF33/USP7 dal nucleo al citoplasma.Abbiamo scoperto che ORF45 ha causato un aumento dell'accumulo di proteine ORF33 che è stato abolito se il dominio di legame ORF33 o USP7 in ORF45 è stato eliminato.Inoltre, la delezione del terminale carbossilico conservato di ORF45 nel genoma di KSHV ha ridotto drasticamente il livello della proteina ORF33 nelle cellule infette da KSHV e ha abolito la produzione di virioni della progenie.Collettivamente, i nostri risultati non solo rivelano nuovi componenti dell'interattoma ORF45, ma dimostrano anche che le interazioni tra queste proteine sono cruciali per la replicazione litica di KSHV. L'herpesvirus associato al sarcoma di Kaposi (KSHV) è l'agente eziologico di diversi tumori umani.KSHV ORF45 è una proteina multifunzionale necessaria per la replicazione litica di KSHV, ma i meccanismi esatti con cui ORF45 svolge le sue funzioni critiche non sono chiari.I nostri studi precedenti hanno rivelato che tutta la proteina ORF45 nelle cellule esiste in complessi ad alto peso molecolare.Abbiamo quindi cercato di caratterizzare l'interattoma di ORF45 per fornire approfondimenti sui suoi ruoli durante la replicazione litica.Utilizzando un pannello di anticorpi monoclonali, abbiamo esaminato l'interattoma ORF45 nelle cellule infette da KSHV.Abbiamo identificato due nuovi partner di legame di ORF45: la proteina virale ORF33 e la proteasi 7 specifica dell'ubiquitina cellulare (USP7).Dimostriamo inoltre che l'interazione tra ORF45 e ORF33 è cruciale per la produzione efficiente di particelle virali di KSHV, suggerendo che l'interferenza mirata con questa interazione può rappresentare una nuova strategia per inibire la replicazione litica di KSHV.