IPTG (isopropil-β-D-tiogalattoside) è un analogo del substrato β-galattosidasi, che è altamente inducibile.Sotto l'induzione dell'IPTG, l'induttore può formare un complesso con la proteina repressore, in modo che la conformazione della proteina repressore venga modificata, in modo che non possa essere combinata con il gene bersaglio e il gene bersaglio sia espresso in modo efficiente.Quindi, come dovrebbe essere determinata la concentrazione di IPTG durante l'esperimento?Più grande è, meglio è?
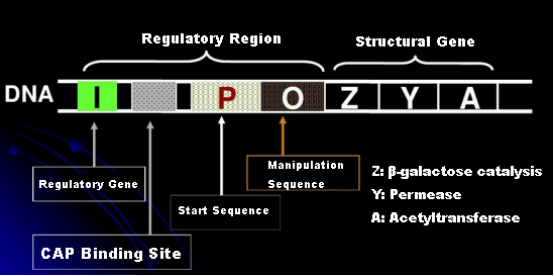
Innanzitutto, comprendiamo il principio dell'induzione dell'IPTG: l'operone (elemento) del lattosio di E. coli contiene tre geni strutturali, Z, Y e A, che codificano rispettivamente per β-galattosidasi, permeasi e acetiltransferasi.lacZ idrolizza il lattosio in glucosio e galattosio, o in allo-lattosio;lacY consente al lattosio presente nell'ambiente di passare attraverso la membrana cellulare ed entrare nella cellula;lacA trasferisce il gruppo acetile dall'acetil-CoA al β-galattoside, il che comporta la rimozione dell'effetto tossico.Inoltre, esiste una sequenza operativa O, una sequenza iniziale P e un gene regolatore I. Il codice del gene I è una proteina repressore che può legarsi alla posizione O della sequenza operatore, in modo che l'operone (meta) sia represso e spento.Esiste anche un sito di legame per il sito di legame proteina-CAP dell'attivatore del gene catabolico a monte della sequenza iniziale P. La sequenza P, la sequenza O e il sito di legame della CAP insieme costituiscono la regione regolatoria dell'operone lac.I geni codificanti dei tre enzimi sono regolati dalla stessa regione regolatoria per ottenere l'espressione coordinata dei prodotti genici.
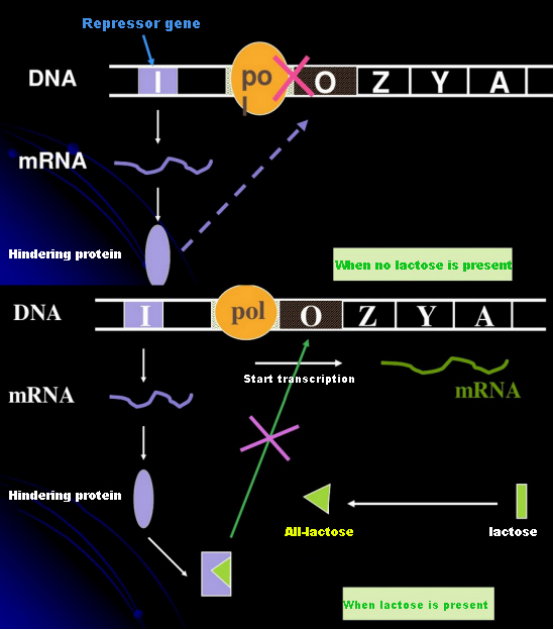
In assenza di lattosio, l'operone lac (meta) è in uno stato di repressione.In questo momento, il repressore lac espresso dalla sequenza I sotto il controllo della sequenza del promotore PI si lega alla sequenza O, che impedisce all'RNA polimerasi di legarsi alla sequenza P e inibisce l'inizio della trascrizione;quando è presente il lattosio, l'operone lac (meta) può essere indotto In questo sistema di operoni (meta), il vero induttore non è il lattosio stesso.Il lattosio entra nella cellula ed è catalizzato dalla β-galattosidasi per essere convertito in allolattosio.Quest'ultima, come molecola induttrice, si lega alla proteina repressore e modifica la conformazione proteica, che porta alla dissociazione della proteina repressore dalla sequenza O e alla trascrizione.L'isopropiltiogalattoside (IPTG) ha lo stesso effetto dell'allolattosio.È un induttore molto potente, che non viene metabolizzato dai batteri ed è molto stabile, quindi è ampiamente utilizzato nei laboratori.
Come determinare la concentrazione ottimale di IPTG?Prendi E. coli come esempio.
Il ceppo di E. coli BL21 geneticamente modificato contenente il pGEX ricombinante positivo (CGRP/msCT) è stato inoculato in terreno liquido LB contenente 50μg·mL-1 Amp e coltivato durante la notte a 37°C.La suddetta coltura è stata inoculata in 10 flaconi di mezzo liquido LB fresco da 50 ml contenente 50 μg·mL-1 Amp in un rapporto di 1:100 per la coltura di espansione e quando il valore OD600 era 0,6 ~ 0,8, IPTG è stato aggiunto alla concentrazione finale.È 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0mmol·L-1.Dopo l'induzione alla stessa temperatura e allo stesso tempo, è stato prelevato 1 mL della soluzione batterica e le cellule batteriche sono state raccolte mediante centrifugazione e sottoposte a SDS-PAGE per analizzare l'influenza delle diverse concentrazioni di IPTG sull'espressione proteica, quindi selezionare la concentrazione IPTG con la massima espressione proteica.
Dopo gli esperimenti, si scoprirà che la concentrazione di IPTG non è la più grande possibile.Questo perché IPTG ha una certa tossicità per i batteri.Il superamento della concentrazione ucciderà anche la cellula;e in generale, speriamo che la proteina più solubile espressa nella cellula, meglio è, ma in molti casi quando la concentrazione di IPTG è troppo alta, si formerà una grande quantità di inclusione.Corpo, ma la quantità di proteine solubili è diminuita.Pertanto, la concentrazione IPTG più adatta spesso non è maggiore è, meglio è, ma minore è la concentrazione.
Lo scopo dell'induzione e della coltivazione di ceppi geneticamente modificati è aumentare la resa della proteina bersaglio e ridurre i costi.L'espressione del gene bersaglio non è solo influenzata dai fattori propri del ceppo e dal plasmide di espressione, ma anche da altre condizioni esterne, come la concentrazione dell'induttore, la temperatura di induzione e il tempo di induzione.Pertanto, in generale, prima che una proteina sconosciuta venga espressa e purificata, è meglio studiare il tempo di induzione, la temperatura e la concentrazione IPTG al fine di selezionare le condizioni appropriate e ottenere i migliori risultati sperimentali.
Tempo di pubblicazione: 31 dicembre 2021

