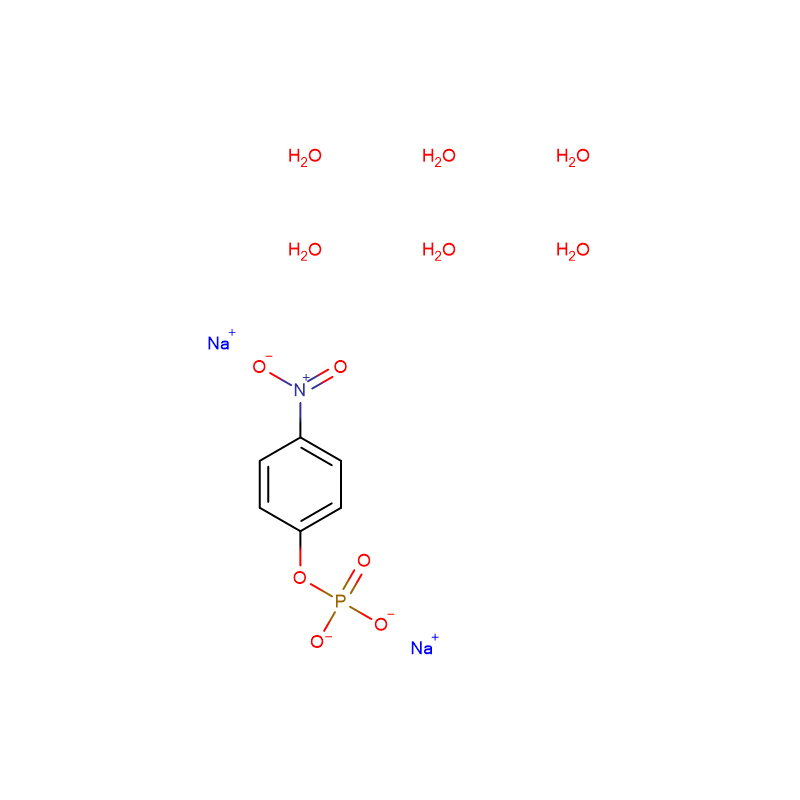
4-nitrofenilfosfato sale disodico 6-idrato CAS:333338-18-4 polvere da bianca a giallo pallido
| Numero di catalogo | XD90511 |
| nome del prodotto | 4-nitrofenil fosfato sale disodico 6-idrato |
| CAS | 333338-18-4 |
| Formula molecolare | C6H16NNa2O12P |
| Peso molecolare | 371.142 |
| Dettagli di archiviazione | Ambientale |
| Codice tariffario armonizzato | 29199000 |
Specifiche di prodotto
| Aspetto | bianco al giallo pallido |
| Saggio | 99% |
Oltre il 70% dei gliomi di basso grado presenta una mutazione eterozigote R132H nel gene che codifica per l'isocitrato deidrogenasi 1 (IDH1).Ciò conferisce all'enzima la nuova capacità di convertire l'α-chetoglutarato in 2-idrossiglutarato, portando infine alla tumorigenesi.La principale fonte di produzione di 2-idrossiglutarato è la glutammina, che, nel cancro, è anche una fonte di anaplerosi del ciclo dell'acido tricarbossilico (TCA).Una fonte alternativa di anaplerosi è il flusso di piruvato attraverso la piruvato carbossilasi (PC), che è un percorso comune negli astrociti normali.L'obiettivo di questo studio era determinare se il PC funge da fonte di anaplerosi TCA nelle cellule mutanti IDH1 in cui la glutammina viene utilizzata per la produzione di 2-idrossiglutarato. Sono stati studiati astrociti umani normali immortalati progettati per esprimere IDH1 mutante eterozigote o IDH1 di tipo selvaggio.Il flusso di piruvato tramite PC e tramite piruvato deidrogenasi (PDH) è stato determinato utilizzando la spettroscopia di risonanza magnetica per sondare l'etichettatura del glutammato e della glutammina guidati da [2-¹³C] derivati dal glucosio ¹³C.Saggi di attività, RT-PCR e western blotting sono stati utilizzati per sondare l'espressione e l'attività degli enzimi rilevanti.I dati del Cancer Genome Atlas (TCGA) sono stati analizzati per valutare l'espressione degli enzimi nei campioni di glioma umano. Rispetto alle cellule wild-type, le cellule IDH1 mutanti hanno aumentato significativamente il flusso frazionario attraverso il PC.Ciò è stato associato a un aumento significativo dell'attività e dell'espressione del PC.Contemporaneamente, l'attività della PDH è diminuita significativamente, probabilmente mediata da un aumento significativo della fosforilazione inibitoria della PDH da parte della chinasi 3 della PDH. tipo IDH. I nostri risultati suggeriscono che i cambiamenti in PC e PDH possono essere una parte importante dell'adattamento cellulare alla mutazione IDH1 e possono servire come potenziali bersagli terapeutici.